 KOWA RECRUITING
KOWA RECRUITING
 KOWA RECRUITING
KOWA RECRUITING

医薬品の開発や製造は、国や都道府県の許認可のもとで行われています。そこで必要になるのが、各種の申請や届出です。治験を実施するために内容を届け出る「治験届」はその代表例ですし、他には製造設備の変更を行う際などにも届出を行っています。これらの手続きを行うには、規制などに関する詳細な知識やノウハウが必要です。私が所属する薬事部は、届出などの業務を専門に受け持ったり、開発や製造部門が書類作成や申請などを行うサポートを行う部署です。
薬事部では医療用医薬品と一般用医薬品の両方を扱っています。私の担当は医療用医薬品。国内における承認申請・届出業務のほかに、海外で申請を行う際に必要になる書類の発給対応なども担当しています。また、業界団体の活動にも参加し、他社の薬事担当者と協力してノウハウの共有などに取り組んでいます。

多くの医薬品メーカーでは、幅広い薬事業務を担当者ごとに振り分けています。対する興和では、1人があらゆる業務を担当することが可能です。求められる知識は多くなりますが、そこが面白さでもあります。
仕事を進めるうえでは、規制当局であるPMDAや同業他社の薬事担当者に問い合わたり相談することも少なくありません。もちろん、自社の開発や製造部門とも頻繁にコミュニケーションをとります。「より良い薬を世の中に送り出そう」という1つの目標に向けて、社内はもちろんのこと業界全体で協力するのが、この仕事ならではの魅力です。
常に勉強が必要な仕事だけに、先輩方に対して気軽に何でも質問できるという興和の社風は非常にありがたいです。私が経験してきたことを後輩へ受け継ぎ、薬事部全体でレベルアップすることが今の目標です。

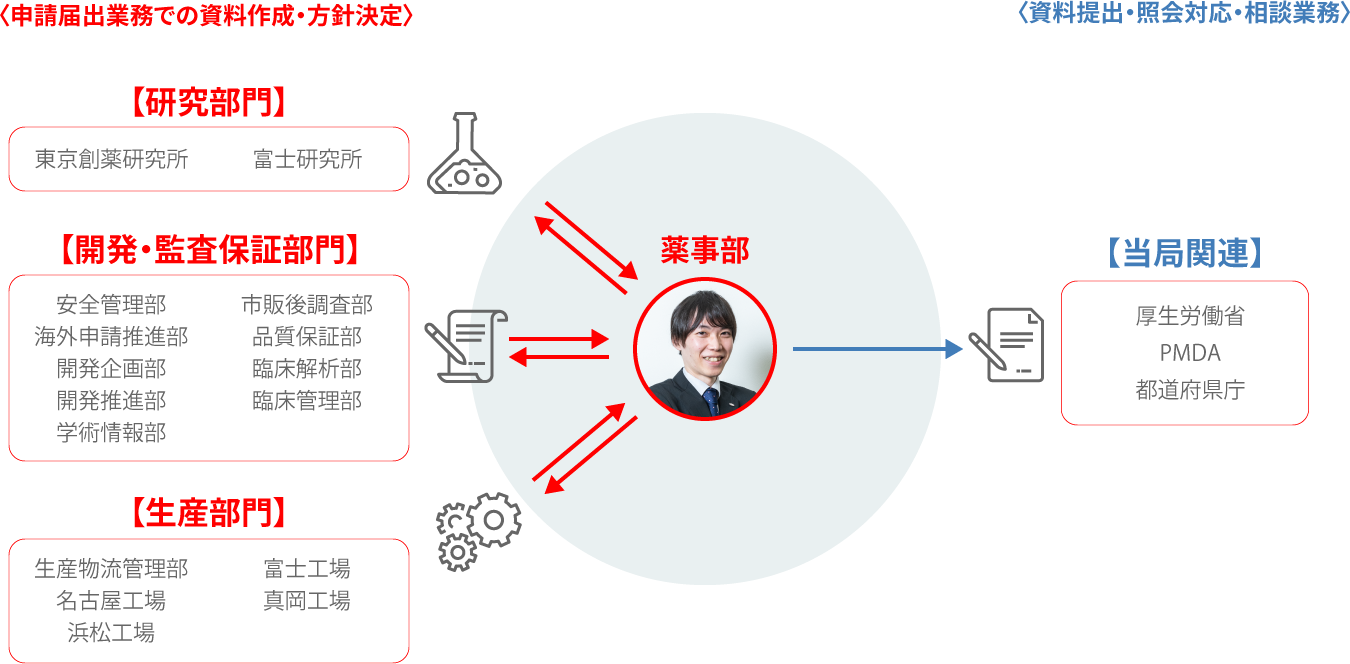
社内からは、各部署の取り組みに関して申請が必要かどうか、どのように申請を行うかなどの問い合わせが寄せられる。必要に応じてPMDAなどに問い合わせたうえで回答するほか、届出書類の作成などをサポートする。

医薬品にまつわるルールは膨大な数があります。書類の書き方などに関する当局からの通知は、1日に複数件届きます。それらを把握することは大変ですが、そこで活きるのが検定試験にも通じる「分からないまま放っておくことが嫌い」という性格です。通知の内容を読み取り、「分かった!」という感覚が得られるととてもすっきりします。

新しいことを知るのが好きで、趣味の延長でこれまでに国内旅行に関する検定や、チョコレート検定、夜景検定など分野を問わず興味がある検定を受験してきました。「分からないまま放っておくことが嫌い」という性格も影響していると思います。それまで知らなかったことを自分の知識で埋めることができたときにとてもすっきりします。
所属部署や掲載内容につきましては取材当時のものです。